Introduction : Le sarcome à cellules claires est une tumeur rare, de mauvais pronostic, représentant moins de 1% des sarcomes des tissus mous. Nous présentons dans le présent article, le cas d’un sarcome à cellules claires des tissus mous, et discutons des aspects cliniques, thérapeutiques et évolutifs de cette pathologie. Observation : Il s’agissait d’un homme âgé de 21 ans, qui avait présenté une masse des tissus mous du bras, sous forme d’une tuméfaction augmentant progressivement de volume. La tomodensitométrie avait objectivé un processus hétérogène du bras droit et l'IRM une anomalie de signal des parties molles de la face antéro-latérale du bras droit. L'examen histopathologique d’une biopsie chirurgicale avait mis en évidence un sarcome à cellules claires. Une exérèse large de la masse avec marges saines fût réalisée. L’évolution était marquée par une rechute ganglionnaire et métastatique pleurale dans un délai de 2 mois suivant la chirurgie. Conclusion : Le sarcome à cellules claires est une tumeur à profil évolutif imprévisible d’où l’intérêt d’une prise en charge multidisciplinaire adaptée pour éviter les récidives.
Introduction: Clear-cell sarcoma is a rare tumor with poor prognosis representing less than 1% of soft tissue sarcomas. We present in this paper the case of soft tissue sarcoma and discuss clinical, therapeutic and prognostic features of this disease. Case: A 21-year-old male patient presented a soft tissue mass in the arm increasing in volume progressively. Computed tomography showed a heterogeneous process of the right arm. MRI revealed a signal abnormality of the soft tissue the the anterolateral part of the right arm. Pathological examination of a surgical biopsy confirmed the diagnosis of a clear cell sarcoma. The patient underwent a wide excision of the mass. Two months later he had lymph node invasion and pleural metastasis. Conclusion: The clear-cell sarcoma is a tumor with unpredictable evolution which requires a multidisciplinary management to avoid recurrences.
Le sarcome à cellules claires (SCC) est une entité rare qui présente des caractéristiques de différenciation mélanocytaire à profil moléculaire distinct et affecte le plus souvent les tendons et les aponévroses des extrémités distales, notamment le pied, la cheville et le genou (43%), puis les poignets et les mains [1]. Souvent, il se présente sous forme d’une tumeur lentement évolutive.

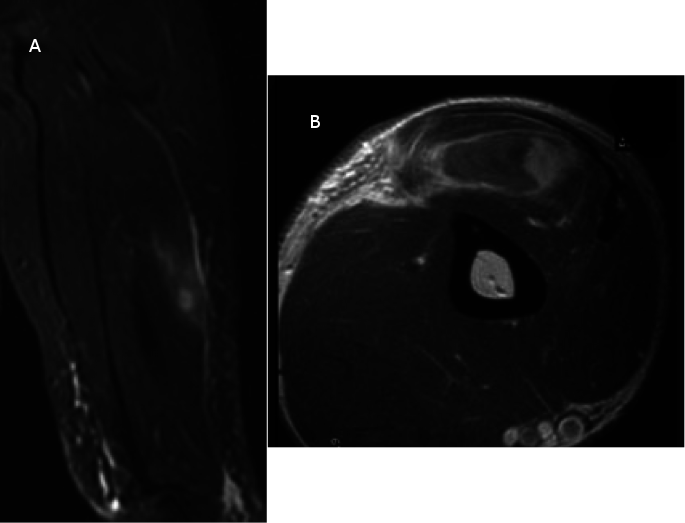
Il s’agissait d’un homme âgé de 21 ans, ayant eu une histoire d'augmentation progressive du volume d’une masse des parties molles du bras droit évoluant depuis environ 2 mois. Une échographie avait montré une masse des tissus mous du tiers moyen du bras, hypoéchogène, hétérogène, vascularisée au doppler, mesurant 27x14 mm. La tomodensitométrie mettait en évidence un aspect en faveur d’une lésion tissulaire de densité hétérogène avec nécrose centrale et extension à la corticale osseuse mesurant 3,75 cm de grand axe (Figure1).
Une biopsie chirurgicale fût réalisée. L’examen histologique révélait une prolifération tumorale mesurant 2,5 x 3 cm composée de cellules rondes, ovales ou fusiformes, disposées en nids ou en lobules séparés par des cloisons fibreuses.
Les cellules avaient un cytoplasme éosinophile, granulaire. Le noyau était rond ou ovoïde, périphérique densifié vésiculaire et centré par un nucléole proéminent, basophile. Les marqueurs immunohistochimiques ont montré que les cellules tumorales exprimaient la protéine S100 et HMB45 et n'exprimaient ni la cytokératine AE1 / AE3, ni la desmine ni l'actine.
Les données morphologiques et immunohistochimiques ont permis de confirmer le diagnostic de sarcome à cellules claires des tendons et des aponévroses.
Le bilan d’extension initial avait compris une IRM du bras qui avait montré la présence d’une anomalie de signal, en plage, des parties molles de la face antéro-latérale du bras droit (Figure 2). La tomodensitométrie thoracique et l’échographie abdominale n'avaient révélé aucune anomalie. Vu l’absence de signe d’appel osseux, la scintigraphie osseuse n’avait pas été réalisée.
Au terme du bilan d’extension et après concertation pluridisciplinaire, il a été décidé de faire une exérèse carcinologique suivie d’une radiothérapie adjuvante.

Une résection large a été réalisée dont l’étude histologique a montré la présence d’une tumeur encapsulée faisant 4 cm de grand axe avec obtention de marges négatives et la présence de quelques ganglions sous-cutanés positifs (Figure 3).
La radiothérapie postopératoire a été envisagée, planifiée dans un délai qui dépassait 2 mois vu les difficultés logistiques et le retard lié aux rendez-vous.
Le scanner dosimétrique a mis en évidence un épanchement pleural de moyenne abondance. L’étude cytologique du liquide pleural a conclu à une origine sarcomateuse.
Suite à cette évolution, un talcage pleural a été réalisé, puis une chimiothérapie de première ligne métastatique a été instaurée, à base de doxorubicine en monothérapie à la dose de 60mg/m2 tous les 21 jours, après évaluation de la fonction cardiovasculaire du bilan hématologique, rénal et hépatique.
Après la 1ère cure, l’état nutritionnel du patient s’était altéré avec un refus d’alimentation, une insomnie et un retrait social.
Une prise en charge en soins palliatifs, un traitement de la douleur et un accompagnement psychologique ont été prodigués au patient.
L’évolution a été marquée, par le décès du patient, après la deuxième cure.
Le sarcome à cellules claires est une rare tumeur des tissus mous, décrite pour la première fois par Enzinger en 1965 [2]. Cette tumeur survient le plus souvent chez les jeunes adultes et atteint les tendons, les aponévroses et les fascias [1-6].
D’après la base de données PALGA, qui est un système national contenant les données de tous les laboratoires néerlandais de pathologie, seulement 30 cas ont pu être enregistrés de la période 1978-1992, les données de prévalence au-delà de cette période ne sont pas encore élaborées mais la fréquence de cette tumeur compte pour 1% de tous les sarcomes des tissus mous.
Le plus souvent, la tumeur survient chez un jeune adulte au niveau des extrémités, toutefois, l'on peut observer un large éventail d'âges et de localisations [3]. La présentation typique est une masse ferme, lentement évolutive et indolore apparaissant aux extrémités distales ou au niveau de la cheville, dont la taille varie généralement entre 5 et 7 cm [7]. Dans la présente observation, la taille de la tumeur faisait 3,75cm au moment du diagnostic.
Le diagnostic de sarcome à cellules claires est basé sur l'aspect histologique caractéristique et le profil immunohistochimique corrélé à un contexte clinique approprié.
L'un des principaux diagnostics différentiels du sarcome à cellules claires est le mélanome malin. Autrefois, la dénomination mélanome des parties molles a également été utilisée en raison de la similitude du tableau clinique (taux élevé de métastases ganglionnaires) et la ressemblance histologique (présence de mélanine, mise en évidence ultrastructurale de mélanosomes et positivité immunohistochimique de la protéine S-100 et l'antigène associé à un mélanome HMB-45) [3]. Cependant, la caractérisation moléculaire du sarcome à cellules claires, a mis en évidence l’existence de la translocation chromosomique t (11, 21) qui en fait une entité génétiquement différente [8].
Les aspects thérapeutiques sont très variés, en partie liés aux nombreux intervenants, soulevant, ainsi, un facteur important qui est celui de l'incertitude diagnostique. Le retard de la prise en charge semble être un facteur pronostique majeur des sarcomes à cellules claires [9].
La prise en charge commence par un diagnostic positif sur imagerie faite par l’IRM qui constitue le meilleur examen non invasif pour étayer l’origine d’une masse des tissus mous; elle est utile pour différencier les lésions bénignes des lésions malignes, et pour déterminer de façon optimale l'étendue de la lésion.
La réalisation d’une biopsie à l’aiguille, ou une biopsie incisionnelle est nécessaire pour une confirmation diagnostique devant une masse suspecte des parties molles dont l’étude morphologique, immunohistochimique et moléculaire permet de conclure à un sarcome à cellules claires [10].
Actuellement, le traitement pivot des sarcomes à cellules claires, au stade précoce est une résection chirurgicale large comme le cas de notre patient [1, 11]. Le sarcome à cellules claires est associé à un taux élevé de récidive locale, de métastases à distance et de métastases ganglionnaires régionales [2, 3]. Bien que l’extension ganglionnaire ne survienne que chez 2 à 6% des patients atteints de sarcomes des tissus mous, les métastases ganglionnaires apparaissent chez 12 à 43% des patients atteints de sarcome à cellules claires [12, 13]. Plusieurs facteurs pronostiques ont été évalués dont les plus importants sont la taille, la présence de nécrose tumorale, le site, la qualité de résection, l’index mitotique, la récidive locale et les métastases à distance [2, 14-16]. Dans la littérature, le pronostic des patients atteints de sarcome à cellules claires est généralement médiocre, avec un taux de survie à 5 ans allant de 47% à 67% [4, 6, 15-17].
Les tumeurs situées au niveau du tronc sont de plus mauvais pronostic car elles sont généralement méconnues et mesurent habituellement plus de 5 cm. En outre, l'exérèse tumorale avec des marges de résection adéquates est difficile en raison de l'anatomie complexe et de l'absence d'un vrai compartiment de fascia.
Dans l'analyse univariée de Kawai et al., les femmes âgées de plus de 30 ans avec une tumeur située dans une extrémité et une taille de tumeur inférieure à 5 cm ont montré un meilleur taux de survie sans progression à 5 ans [16].
Le taux de survie globale à 5 ans, en cas de sarcome à cellules claires avec présence de métastases ganglionnaires, varie entre 40% et 68% [8, 12-16].
La technique de biopsie du ganglion sentinelle dans le sarcome à cellules claires a été rapportée dans le but de classer la maladie avec précision et de suggérer un curage ganglionnaire si le résultat est positif. Cependant, le bénéfice de cette procédure nécessite encore la validation par des études plus poussées dont la réalisation serait difficile en raison de la rareté de la tumeur [18, 19].
Le traitement multimodal incluant la radiothérapie préopératoire ou postopératoire et la chimiothérapie est devenu le moyen conventionnel du traitement de la plupart des tumeurs malignes. Cependant, l'effet de la radiothérapie et de la chimiothérapie sur les sarcomes à cellules claires, n'est pas encore élucidé [20].
La radiothérapie adjuvante a été utilisée dans la plupart des séries, vraisemblablement en raison des similitudes du sarcome à cellules claires avec les autres sarcomes des tissus mous et de l’apport non encore suffisamment démontré de la chimiothérapie en matière de survie [1]. Étant donné la probabilité que le comportement du sarcome à cellules claires soit différent d’un sarcome des tissus mous typique, et vu les découvertes récentes concernant le profil d'expression génique, l’approche multimodale nécessiterait ainsi une remise en question.
D’autres modalités thérapeutiques ont été proposées dont la perfusion du membre isolé, qui s'est révélée utile dans le sarcome, le mélanome, et dans le contexte d'une maladie incontrôlée au niveau d’une extrémité, afin d’administrer des doses élevées de chimiothérapie à base de TNF et de permettre la conservation de membres [17, 18].
La fréquence élevée des récidives locales et de maladie métastatique exige un suivi clinique étroit des patients atteints de SCC. La survenue de récidives très tardives (> 10 ans) est fréquente, ce qui pourrait conduire à la surestimation des résultats de survie à 5 ans. Les calendriers de suivi devraient ainsi en tenir compte.
La chimiothérapie peut être mieux évaluée avec la possibilité de traitement de cette entité par des drogues spécifiques. Le progrès de la biologie moléculaire promet une meilleure compréhension de la physiopathologie permettant ainsi un enrichissement de l’arsenal thérapeutique.
- Clark M, Johnson M, Thway K, Fisher C, Thomas J, Hayes A. Clear cell sarcoma (melanoma of soft parts): The Royal Marsden Hospital experience. Eur J Surg Oncol. 2008;34:800-4 pubmed
- Enzinger F. CLEAR-CELL SARCOMA OF TENDONS AND APONEUROSES. AN ANALYSIS OF 21 CASES. Cancer. 1965;18:1163-74 pubmed
- Chung E, Enzinger F. Malignant melanoma of soft parts. A reassessment of clear cell sarcoma. Am J Surg Pathol. 1983;7:405-13 pubmed
- Lucas D, Nascimento A, Sim F. Clear cell sarcoma of soft tissues. Mayo Clinic experience with 35 cases. Am J Surg Pathol. 1992;16:1197-204 pubmed
- Ferrari A, Casanova M, Bisogno G, Mattke A, Meazza C, Gandola L, et al. Clear cell sarcoma of tendons and aponeuroses in pediatric patients: a report from the Italian and German Soft Tissue Sarcoma Cooperative Group. Cancer. 2002;94:3269-76 pubmed
- Mavrogenis A, Bianchi G, Stavropoulos N, Papagelopoulos P, Ruggieri P. Clinicopathological features, diagnosis and treatment of clear cell sarcoma/melanoma of soft parts. Hippokratia. 2013;17:298-302 pubmed
- Fujimura Y, Ohno T, Siddique H, Lee L, Rao V, Reddy E. The EWS-ATF-1 gene involved in malignant melanoma of soft parts with t(12;22) chromosome translocation, encodes a constitutive transcriptional activator. Oncogene. 1996;12:159-67 pubmed
- Prieskorn D, Irwin R, Hankin R. Clear cell sarcoma presenting as an interdigital neuroma. Orthop Rev. 1992;21:963-70 pubmed
- Schwartz J, Zollars P. Fine needle aspiration cytology of malignant melanoma of soft parts. Report of two cases. Acta Cytol. 1990;34:397-400 pubmed
- Fong Y, Coit D, Woodruff J, Brennan M. Lymph node metastasis from soft tissue sarcoma in adults. Analysis of data from a prospective database of 1772 sarcoma patients. Ann Surg. 1993;217:72-7 pubmed
- Sara A, Evans H, Benjamin R. Malignant melanoma of soft parts (clear cell sarcoma). A study of 17 cases, with emphasis on prognostic factors. Cancer. 1990;65:367-74 pubmed
- Deenik W, Mooi W, Rutgers E, Peterse J, Hart A, Kroon B. Clear cell sarcoma (malignant melanoma) of soft parts: A clinicopathologic study of 30 cases. Cancer. 1999;86:969-75 pubmed
- Finley J, Hanypsiak B, McGrath B, Kraybill W, Gibbs J. Clear cell sarcoma: the Roswell Park experience. J Surg Oncol. 2001;77:16-20 pubmed
- Kawai A, Hosono A, Nakayama R, Matsumine A, Matsumoto S, Ueda T, et al. Clear cell sarcoma of tendons and aponeuroses: a study of 75 patients. Cancer. 2007;109:109-16 pubmed
- Picciotto F, Zaccagna A, Derosa G, Pisacane A, Puiatti P, Colombo E, et al. Clear cell sarcoma (malignant melanoma of soft parts) and sentinel lymph node biopsy. Eur J Dermatol. 2005;15:46-8 pubmed
